Il nous semblait important de parler de cette nouvelle classe qui est prescrit par nos confrères cardiologue chez des patients présentant une insuffisance cardiaque insuffisament contrôlé par IEC/ARA II: les inhibiteurs du récepteur de l’angiotensine et de la néprilysine. La population semble être restreint mais apporte un bénéfice.
Que nous dit l'HAS ? Le résumé caractéristique du produit ? Le laboratoire ? On a tenté de résumé ce qu'on trouvait sur le net.
Qu'en pensez vous ? Parlez en nous dans les commentaires.
🔵Modèle du médicament
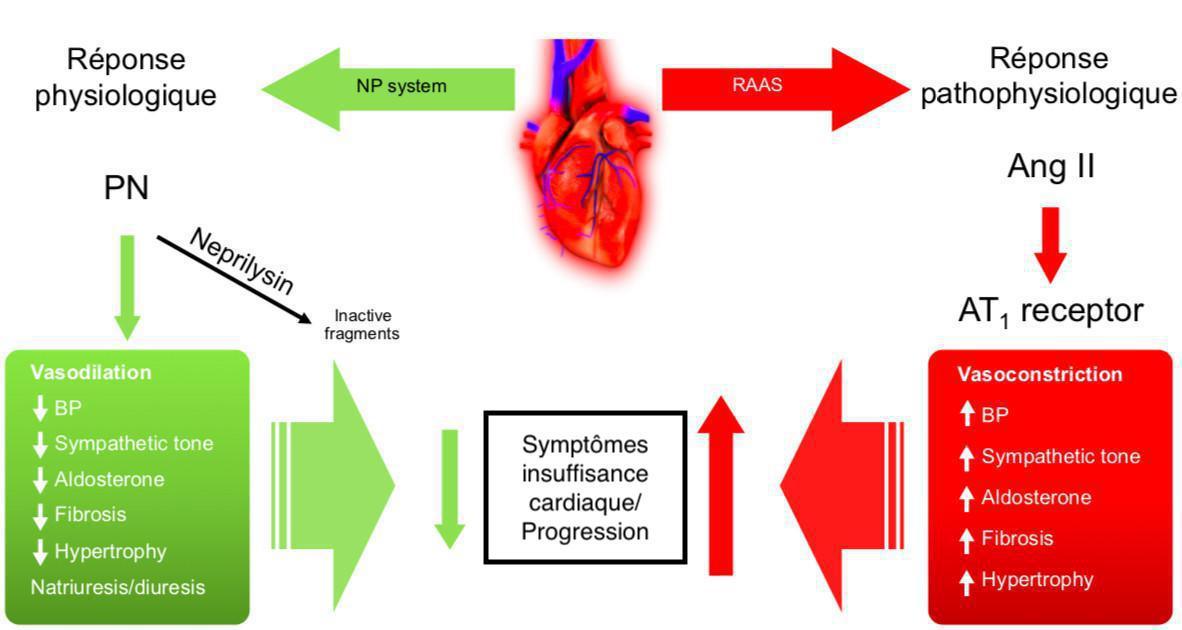
Le système rénine angiotensine aldostérone (SRAA) et le système des peptides natriurétiques sont des mécanismes de contre régulation dans l'insuffisance cardiaque.
Dans l'insuffisance cardiaque avancé: le SRAA devient le système neurohormonal activé prédominant.
Cliquez sur l'image pour l'agrandir
🔵 Quel est le mécanisme d'action ?
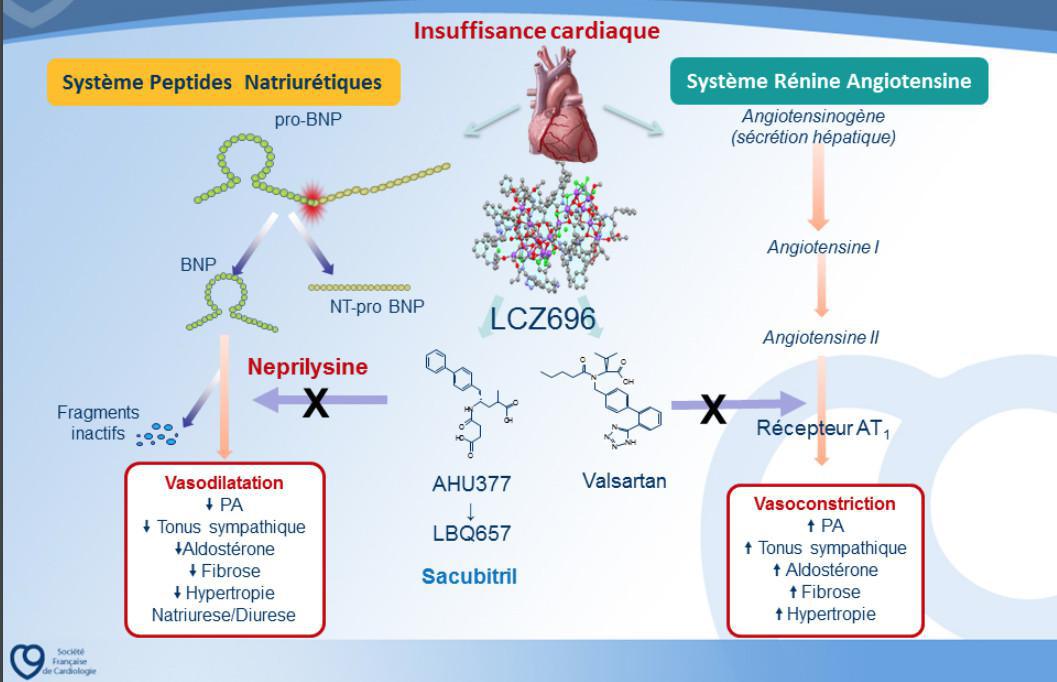
Entresto présente le mécanisme d’action
- d’un inhibiteur du récepteur de l’angiotensine
- et de la néprilysine en inhibant à la fois la néprilysine (neutral endopeptidase, NEP) via le LBQ657, métabolite actif du promédicament sacubitril et en bloquant le récepteur de type 1 de l’angiotensine II (AT1) via le valsartan.
Les effets cardiovasculaires complémentaires d’Entresto chez les patients atteints d’insuffisance cardiaque sont attribués à l’augmentation des peptides qui sont dégradés par la néprilysine tels que les peptides natriurétiques (NP) par LBQ657 et l’inhibition simultanée des effets de l’angiotensine II par le valsartan.
Les pepides natriurétiques exercent leurs effets physiologiques en activant des récepteurs membranaires à activité guanylate-cyclase, entraînant une augmentation des concentrations du second messager hormonal, la guanosine monophosphate cyclique (GMPc). Ceci peut entraîner une vasodilatation, une natriurèse et une diurèse, une augmentation de la filtration glomérulaire et du débit sanguin rénal, une inhibition de la libération de rénine et d’aldostérone ainsi qu’une diminution de l’activité sympathique, et des effets anti-hypertrophique et anti-fibrotique.
Le valsartan empêche les effets néfastes cardiovasculaires et rénaux de l’angiotensine II en bloquant sélectivement les récepteurs AT1 ainsi que la libération d’aldostérone dépendante de l’angiotensine II. Cela prévient l’activation continue du système rénine-angiotensine-aldostérone et provoque une vasoconstriction, une rétention hydrosodée, une activation de la croissance et de la prolifération des cellules entraînant un remodelage cardiovasculaire mal adapté.
🔵 Efficacité et sécurité clinique: etude PARADIGM-HF
Il s'agit d'une étude de phase III,
- comparant ENTRESTO (valsartan/sacubitril) à 200 mg 2 fois par jour à l’énalapril 10 mg 2 fois par jour, en association au traitement optimal standard (excluant IEC et ARA II),
- randomisées en double-aveugle, réalisées chez 8 399 patients adultes traités, avec une insuffisance cardiaque et FEVG ≤ 40 puis amendée à ≤ 35%( FEVG ≤ 40% puis 35% par amendement au protocole 1 an après l’inclusion du premier patient) .
- L’étude devait se poursuivre jusqu’à ce que 2 410 patients présentent un événement.
- La période de randomisation a été précédée d’une période de run-in au cours de laquelle tous les patients ont reçu de l’énalapril 10 mg 2 fois par jour pendant 2 semaines puis ENTRESTO 100 mg 2 fois par jour pendant 2 semaines puis ENTRESTO 200 mg 2 fois par jour pendant 2 semaines.
Critères d’inclusion : patients adultes avec une insuffisance cardiaque de classe II à IV NYHA et :
- une FEVG ≤ 40% puis abaissée à 35%,
- BNP(brain natriuretic peptide ) ≥ 150 pg/ml (ou NT-proBNP( N-terminal pro-brain natriuretic peptide ) ≥ 600 pg/ml) ou BNP ≥ 100 pg/mL (ou NT-proBNP ≥ 400 pg/ml) pour les patients hospitalisés dans les 12 mois précédant l’inclusion,
- Sous traitement stable depuis au moins 4 semaines par IEC ou ARA II à dose équivalente à 10 mg 2 fois par jour d’énalapril, un bêtabloquant et un antagoniste de l’aldostérone, si indiqués.
Critères de non inclusion, notamment :
- Antécédents d’hypersensibilité ou d’allergie à un des traitements utilisés dans l’étude,
- Intolérance aux IEC ou aux sartans aux doses cibles,
- Antécédents d’angioedème.
Critère de jugement principal : nombre de premiers événements cardiovasculaires associant les décès d’origine cardiovasculaire ou une première hospitalisation pour insuffisance cardiaque (critère combiné).
Le nombre d’événements attendus à la fin de l’étude était de 2 410 en ce qui concerne le critère combiné et de 1 229 décès cardiovasculaire.
La puissance statistique a été déterminée sur la mortalité cardiovasculaire.
Critères de jugement secondaires (hiérarchisés), notamment :
- chacun des critères du critère principal : mortalité cardiovasculaire, hospitalisation pour insuffisance cardiaque,
- mortalité toutes causes.
RESULTATS :
- Les caractéristiques des patients à l’inclusion étaient comparables.
- La majorité des patients inclus avaient un antécédent d’hospitalisation pour insuffisance cardiaque (62,77%).
- Leur FEVG était en moyenne de 29,48% ± 6,21, et :
- 70,33% des patients étaient en classe II,
- 24,11 en classe III,
- 0,71% en classe IV.
- L’âge moyen des patients était de 63,80 (11,38) ans (âge médian 64 ans).
- Environ 18% des patients inclus étaient âgés de plus de 75 ans.
- Des défibrillateurs implantables étaient présents chez 14,8% des patients inclus et 36% des patients présentaient une FA.
- Les traitements concomitants étaient principalement :
- Bêtabloquants chez 93% des patients,
- Digoxine chez 30%,
- Diurétiques chez 81%,
- Antagoniste de l’aldostérone chez 55%,
- Statines chez 57%.
Cliquez sur l'image pour l'agrandir
- Dans le groupe Entresto, 76% des patients sont restés à la posologie cible de 200 mg deux fois par jour jusqu’à la fin de l’étude (dose journalière moyenne de 375 mg).
- Dans le groupe énalapril, 75% des patients sont restés à la posologie cible de 10 mg deux fois par jour jusqu’à la fin de l’étude (dose journalière moyenne de 18,9 mg).
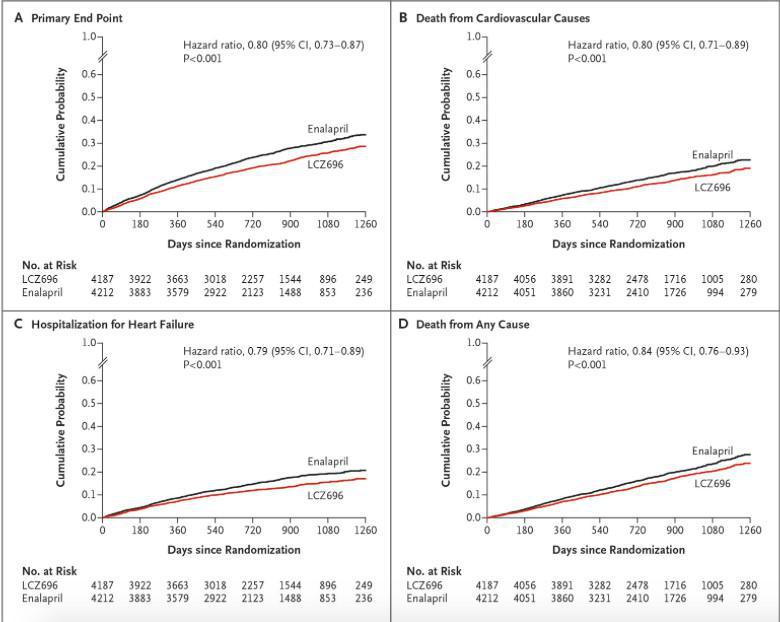
- Entresto était supérieur à l’énalapril en réduisant le risque de décès d’origine cardiovasculaire ou d’hospitalisations pour insuffisance cardiaque de 21,8% par rapport à 26,5% avec l’énalapril.
- Les réductions du risque absolu étaient de 4,7% pour le critère composite des décès d’origine CV ou des hospitalisations pour IC, de 3,1% pour la mortalité CV seule et de 2,8% pour la 1ère hospitalisation pour IC seule.
- La réduction du risque relatif était de 20% par rapport à l’énalapril (voir tableau 2).
- Cet effet a été observé précocement et s’est maintenu pendant toute la durée de l’essai. Les deux composantes du critère ont contribué à la réduction du risque.
- La mort subite a contribué à 45% des décès d’origine cardiovasculaire et a été diminuée de 20% chez les patients traités par Entresto en comparaison aux patients traités par l’énalapril (HR : 0,80, p=0,0082).
- La défaillance cardiaque a contribué à 26% des décès d’origine cardiovasculaire et a été diminuée de 21% chez les patients traités par Entresto en comparaison aux patients traités par l’énalapril (HR : 0,79, p=0,0338).
- Cette réduction du risque a été observée de façon cohérente et homogène dans l’ensemble des sousgroupes incluant : le sexe, l’âge, l’origine ethnique, la situation géographique, la classe de la NYHA (II/III), la fraction d’éjection, la fonction rénale, les antécédents de diabète ou d’hypertension artérielle, le traitement antérieur de l’insuffisance cardiaque et la fibrillation auriculaire.
- Entresto a amélioré la survie en diminuant significativement la mortalité toutes causes confondues de 2,8% (Entresto 17%, énalapril 19,8%). La réduction du risque relatif était de 16% par rapport à l’énalapril (voir tableau 2).
Effet du traitement concernant le critère d’évaluation principal composite, ses composantes et la mortalité toutes causes confondues au cours de la période moyenne de suivi de 27 mois
| Entresto N = 4 187♯ n (%) | Énalapril N = 4 212♯ n (%) | Hazard ratio (IC 95%) | Réduction du Risque Relatif | Valeur de p *** |
|
| Critère d’évaluation principal composite regroupant la mortalité CV et les hospitalisations pour insuffisance cardiaque* | 914 (21,83) | 1117 (26,52) | 0,80 (0,73, 0,87) | 20 % | 0,0000002 |
| Composantes individuelles du critère d’évaluation principal composite | |||||
| Mortalité CV ** | 558 (13,33) | 693 (16,45) | 0,80 (0,71, 0,89) | 20 % | 0,00004 |
| Première hospitalisation pour insuffisance cardiaque | 537 (12,83) | 658 (15,62) | 0,79 (0,71, 0,89) | 21 % | 0,00004 |
| Critère d’évaluation secondaire | |||||
| Mortalité toutes causes confondues | 711 (16,98) | 835 (19,82) | 0,84 (0,76, 0,93) | 16 % | 0,0005 |
- * Le critère d’évaluation principal a été défini comme le délai de survenue du premier événement de décès d’origine CV ou d’hospitalisations pour IC.
- ** Les décès d’origine CV incluent tous les patients décédés jusqu’à la date limite, qu’ils aient été hospitalisés ou non.
- *** Valeur p unilatérale.
- ♯ Échantillon complet d’analyse (Full Analysis Set, FAS)
🔵 L'avis de l'HAS
Service Médical rendu: Compte tenu de ces éléments, la Commission considère que le service médical rendu par ENRESTO (valsartan/sacubitril) est important chez des patients avec insuffisance cardiaque de classe II ou III selon la classification de la NYHA avec une FEVG ≤ 35%, qui restent symptomatiques malgré un traitement par IEC ou sartan et nécessitent une modification de traitement.
Amélioration du Service Médical rendu: Compte tenu des résultats de l’étude PARADIGM-HF et du profil des patients inclus ENTRESTO apporte une amélioration du service médical rendu mineure (ASMR IV) chez des patients avec insuffisance cardiaque de classe II ou III selon la classification de la NYHA avec une FEVG ≤ 35%, qui restent symptomatiques malgré un traitement par IEC ou sartan et nécessitent une modification de traitement.
Discussion de la comission: Les patients inclus dans l’étude étaient stabilisés par leur traitement, asymptomatiques. De ce fait, la transposabilité en pratique clinique est difficilement appréciable. De plus, l’intérêt de proposer un changement de traitement à des patients stabilisés et asymptomatiques n’est pas cliniquement pertinent.
Aucune étude dont l’objectif était de comparer l’efficacité en termes de morbi-mortalité du valsartan seul par rapport à l’ajout sacubitril n’est actuellement disponible ; les seules données comparatives sont issues de l’étude PARAMOUNT qui a comparé l’efficacité de ces deux traitements sur un critère biologique (variation du NT-proBNP) dans une population hors AMM (patients avec fonction ventriculaire préservée). Ainsi, l’intérêt de l’ajout du sacubitril au valsartan en termes de prévention des événements cardiovasculaires par rapport au valsartan seul ne peut être clairement établi.
🔵 Place dans la stratégie thérapeutique
ENTRESTO peut être proposé aux patients avec insuffisance cardiaque de classe II ou III selon la classification de la NYHA avec une FEVG ≤ 35%, préalablement traités par IEC ou sartan qui restent symptomatiques et nécessitent une modification de traitement.
🔵 Effets indésirables
- l’hypotension,
- l’hyperkaliémie
- et une altération de la fonction rénale
- des angioedèmes ont été rapportés
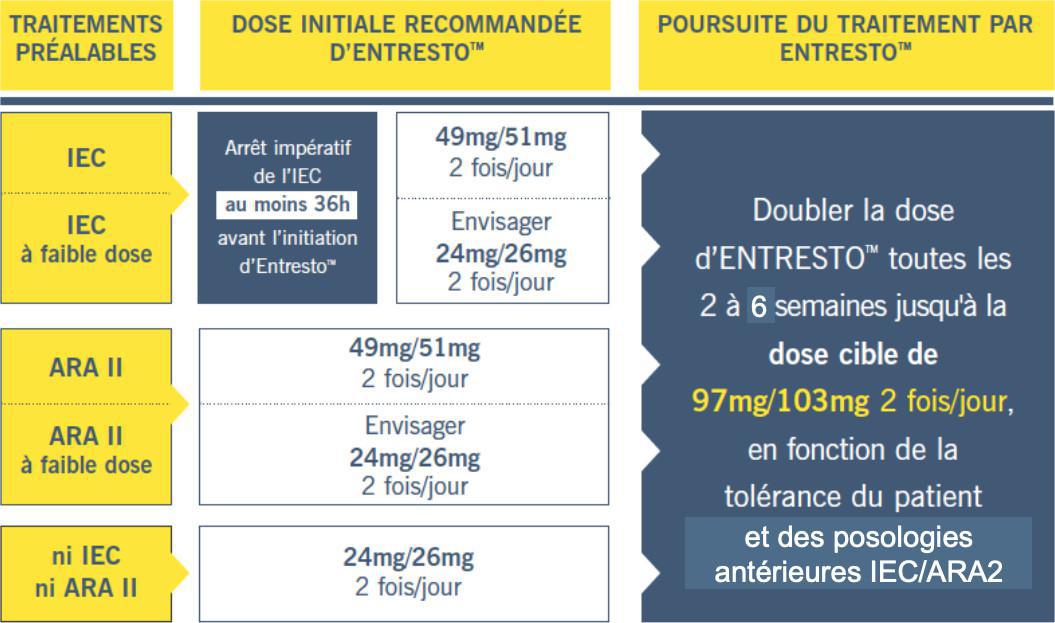
🔵 Comment faire le switch ?
Cliquez sur l'image pour l'agrandir
🔵 Biologie ? BNP et NT proBNP ?
Le BNP ne peut pas être utiliser pour juger de l'efficacité du traitement mais le NT proBNP si.
Le BNP étant un substrat de la néprilysine (au contraire du NT-proBNP), la dégradation du BNP est inhibée en raison de l’effet de l’ARNI( (inhibiteurs du récepteur de l’angiotensine et de la néprilysine) et le taux de BNP augmente
Cliquez sur l'image pour l'agrandir
Atchoum vous propose gratuitement des articles hebdomadaires, soutenez nous.
📨 Écrivez-nous à cette adresse pour nous suggérer une publication ou si vous voulez proposer votre article on a toujours besoin d’aide !
Partagez ! Commentez !
Et si vous avez des médias (photos, vidéos…) envoyez les nous via l'application pour implémenter nos articles ! (en haut à droite le bouton rouge).
Sources des données:
- HAS COMMISSION DE LA TRANSPARENCE Avis 11 mai 2016 https://www.has-sante.fr/portail/upload/docs/evamed/CT-14835_ENTRESTO_PIC_INS_Avis3_CT14835.pdf
- RCP Entresto https://www.ema.europa.eu/documents/product-information/entresto-epar-product-information_fr.pdf
- Pr M. GALINIER Pôle Cardio Vasculaire et Métabolique CHU Rangueil, Toulouse France https://afmp.info/IMG/pdf/_lcz696_evolution_ou_revolution_paradigm-2.pdf
- Roche http://www.roche-diagnostics.ch/content/dam/corporate/roche-dia_ch/documents/broschueren/professional_diagnostics/praxislabor/kardiale_marker/cobas-h-232-poc-nt-probnp/07998660001_FR_NT-proBNP_Flyer.pdf
Atchoum vous propose gratuitement des articles hebdomadaires, soutenez nous.
📨 Écrivez-nous à cette adresse pour nous suggérer une publication ou si vous voulez proposer votre article on a toujours besoin d’aide !
Partagez ! Commentez !
Et si vous avez des médias (photos, vidéos…) envoyez les nous via l'application pour implémenter nos articles ! (en haut à droite le bouton rouge).